晚期糖基化终末产物(Advanced Glycation End Products, AGEs)是由一系列糖基化反应产生的一类化合物。当蛋白质、脂质和核酸暴露于糖类中,就会发生这种反应。AGEs是连续糖基化反应的结果。糖基化是一种非酶促的多步骤反应,发生在还原糖的羰基和蛋白质的氨基或N端基团之间。由于AGEs的异质性、复杂性和不稳定的性质,很难确定所有形成的化合物及其后续作用。
AGEs的产生既有内源性的,通过“正常的”代谢过程,也有外源性的,由饮食和吸烟等环境因素造成。研究表明AGEs与许多退行性疾病有关。随着年龄的增长,负责清除和还原AGEs的机制变得效率低下,导致它们的积累。AGE这个单词本来就有年龄、衰老的意思。
AGEs、糖基化反应也被通俗地称为“糖化”,于是“抗糖化”的说法就像抗氧化一样流传开来。
AGE的致病机制:
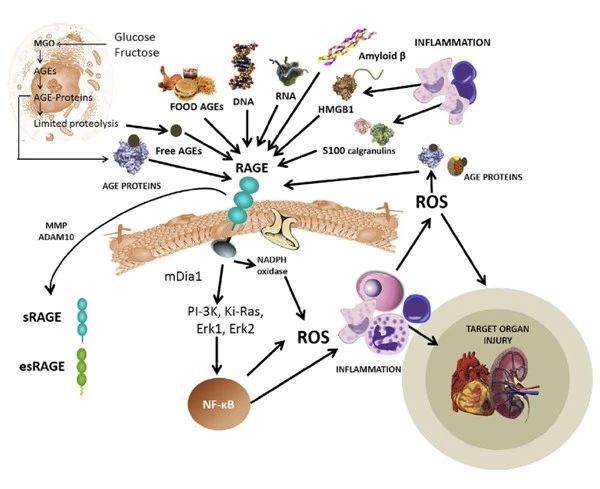
1.受体依赖途径:AGE与特异性晚期糖基化终末产物受体(receptor of advanced glycation end products,RAGE)结合并产生一系列病理效应是其导致胰岛素抵抗及糖尿病并发症的主要机制。AGE与RAGE的细胞外结构域结合并诱导激活其细胞质结构域,产生多种信号通路,包括丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、c-Jun氨基末端激酶/应激活化蛋白激酶、细胞外调节蛋白激酶和Janus激酶信号转导子和转录激活子等,从而持续激活细胞内核转录因子-κB(nuclear factor kappa-B,NF-κB)、信号转导和转录激活因子3等,最终上调各种炎性细胞因子,并激活还原型烟酰胺腺嘌呤氧化酶生成活性氧 。AGE/RAGE轴激活的炎症因子与活性氧是AGE参与微血管并发症发病机制的关键因素。同时,AGE/RAGE轴亦可通过级联信号转导生成多种促纤维化因子,如血管细胞黏附因子、细胞间黏附因子、纤溶酶原激活物抑制剂等,同时促进低密度脂蛋白氧化以激活MAPK等细胞内途径,进一步增加炎性细胞因子等表达,促进血管硬化 ,参与大血管并发症的发病。此外,据推测,早期高血糖发生导致AGE通过结合RAGE与氧化应激形成正向反馈,随着时间推移氧化应激不断加重,导致线粒体DNA损伤、线粒体呼吸链蛋白糖基化,最终形成独立于高血糖的恶性循环,可能是代谢记忆效应的机制之一 。
近年来有研究揭示了AGE/RAGE诱导胰岛素抵抗及促进糖尿病并发症发生的新机制。一项基础研究表明,RAGE介导NF-κB信号通路,能够促进NLRP3炎症小体形成,NLRP3炎症小体通过裂解半胱天冬酶-1,促进可介导胰岛素抵抗的炎症因子如白细胞介素-1β等的合成与分泌 。此外,细胞和小鼠体内实验发现,AGE与RAGE相互作用激活NF-κB亦能够促进肾脏中足细胞肝素酶的表达,肝素酶降解肾小球基底膜的组成部分硫酸肝素从而破坏肾小球滤过屏障,最终导致糖尿病肾脏病的发生 。AGE还能够激活斑块巨噬细胞中的RAGE/Toll样受体4途径,促进δ样配体4的表达,高表达δ样配体4的血管平滑肌细胞在巨噬细胞调控下通过Notch途径发生表型转化,从而导致动脉粥样硬化 。
可溶性RAGE是仅有胞外区的一类RAGE,由于缺少胞内区,其仅有与AGE结合的能力,无法完成信号转导。可溶性RAGE可作为AGE的“诱饵”,阻断AGE与全长RAGE结合产生相互作用,从而下调炎症和氧化应激反应。已有研究证明,可溶性RAGE水平与糖尿病患者动脉粥样硬化标志物成反比,可作为并发症的标志物 。
2.非受体依赖途径:
AGE可直接与蛋白质之间发生交联而影响其结构和功能。一方面,AGE可修饰细胞外蛋白质如胶原蛋白、弹性蛋白和层黏连蛋白等基底膜和结缔组织的关键结构蛋白,而糖化后的细胞外蛋白质可与其他蛋白形成交联、损害内皮细胞黏附迁移,最终导致血管弹性降低、舒张受损。近来,有研究者发现,AGE能够介导肝细胞外基质交联,拮抗巨噬细胞介导的重构,最终导致肝纤维化 。另一方面,AGE亦可与细胞内蛋白质结合,并在内质网积累,阻碍正常的蛋白质折叠,从而影响细胞功能 。