铁死亡(Ferroptosis )是一种铁依赖性的,区别于细胞凋亡、细胞自噬的新型的细胞程序性死亡方式。
自2012年首次提出以来,铁死亡的研究迅速引起了广泛关注,成为细胞生物学和疾病研究的重要领域。研究表明,铁死亡与多种疾病密切相关,包括癌症、代谢性疾病、自身免疫性疾病、遗传性疾病、心血管疾病、神经退行性疾病以及骨骼肌疾病。因此,检测铁死亡在临床研究中显得尤为重要。目前,铁死亡的检测通常需要综合多个指标进行评估。让我们一同来了解一下吧!
在铁死亡的过程中,细胞活性往往会逐步下降。这主要是由于脂质过氧化、抗氧化系统中谷胱甘肽的消耗,以及谷胱甘肽过氧化物酶(GPX4)活性降低等多种因素的共同影响。这些因素导致细胞膜脂质受损,最终引发细胞的死亡。
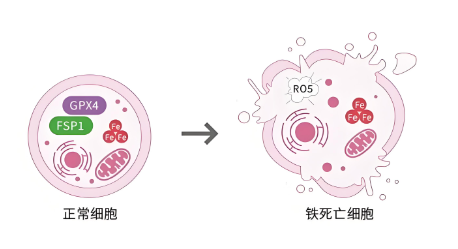
铁的代谢过程涉及其氧化还原特性,使其能够作为蛋白质的辅助因子,发挥生物学功能。在正常生理状态下,三价铁(Fe3+)与转铁蛋白(transferrin, TF)结合形成复合物,并通过与细胞膜上的转铁蛋白受体(transferrin receptor, TFR)结合,将铁以铁蛋白(ferritin, FT)的形式储存于细胞内。细胞内的二价铁(Fe2+)在氧化酶的作用下,通过膜铁转运蛋白(ferroportin, FPN)被转运至细胞外,并被氧化为三价铁(Fe3+),再与转铁蛋白结合,从而发挥其生物学功能,这一过程有助于维持细胞内铁离子的动态平衡。然而,当铁的输出受到阻碍时,细胞内的铁会过量积累,这种铁的积聚是诱发膜氧化损伤的重要信号。细胞内的Fe3+会被前列腺六跨膜表皮抗原3(six-transmembrane epithelial antigen of prostate 3, STEAP3)还原为Fe2+。当部分Fe2+与过氧化氢和氧同时存在时,会通过芬顿反应[Fe2++H2O2→Fe3++(OH)-+OH]产生大量活性氧(ROS),从而诱发铁死亡;而另一部分Fe2+则作为辅助因子,增强代谢酶的活性。因此,铁的过量参与了脂质过氧化和自由基的生成,对铁死亡的调控具有重要意义。
ROS是细胞内有氧代谢过程中产生的具有高度活性的含氧分子或原子团,包括超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(·OH)等。
在铁死亡过程中,ROS主要来源于铁离子与过氧化氢的芬顿反应(Fenton reaction),即Fe2+与H2O2反应生成·OH和Fe3+,·OH是一种极强的氧化剂,能够攻击细胞膜上的脂质分子。
脂质过氧化是指细胞膜上的脂质分子(特别是多不饱和脂肪酸)在ROS的攻击下发生过氧化反应,形成脂质过氧化物(如丙二醛MDA、4-羟基壬烯醛4-HNE等)。这些脂质过氧化物会进一步嵌入细胞膜中,破坏细胞膜的完整性和稳定性,导致细胞死亡。脂质过氧化是铁死亡的核心机制之一。在铁死亡过程中,ROS促进脂质过氧化,导致细胞膜损伤和线粒体功能障碍。同时,脂质过氧化还会引发一系列连锁反应,如蛋白质羰基化、DNA损伤等,进一步加剧细胞死亡。
谷胱甘肽,特别是还原型谷胱甘肽(GSH),在细胞内起着重要的抗氧化作用。它是谷胱甘肽过氧化物酶4(GPX4)的辅因子,参与脂质过氧化物的还原代谢。在铁死亡过程中,谷胱甘肽的耗竭和GPX4活性的下降是导致脂质过氧化积累的关键因素。
线粒体膜电位的降低是铁死亡过程中的一个重要特征。通过检测线粒体膜电位,可以评估线粒体功能的完整性,从而间接反映铁死亡的发生情况。
JC-1荧光探针法:JC-1是一种广泛用于检测线粒体膜电位的荧光染料。在正常细胞中,JC-1聚集在线粒体的基质中,形成聚合物,发出红色荧光;而在线粒体膜电位降低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,发出绿色荧光。因此,可以通过观察红色荧光和绿色荧光的比例来判断线粒体膜电位的变化。